Mehr als 150 Journalistinnen und Journalisten berichten rund um die Uhr für Sie über das Geschehen in Deutschland und der Welt.
Zum journalistischen Leitbild von t-online.Neue Daten vorgelegt So gut schützen die Corona-Impfstoffe von Astrazeneca und Biontech

Kurz nach dem Corona-Impfstofferfolg der Pharmafirmen Biontech und Pfizer sowie Moderna meldet jetzt auch der britisch-schwedische Konzern Astrazeneca eine hohe Wirksamkeit. Was bedeuten die Prozentangaben?
Inhaltsverzeichnis
- Astrazeneca: Wirksamkeit von 70 Prozent
- Zulassungsprozess in USA und EU: Biontech und Pfizer
- US-Unternehmen Moderna: Was 94,5-prozentige Wirksamkeit bedeutet
- Russlands "Sputnik V": angeblich 92-prozentige Wirksamkeit
- Diese Corona-Impfstoffe sind noch in der letzten Testphase
- Mehrere Test-Etappen bis zum Zulassungsverfahren
- Einer von zwei Kandidaten: Beijing Institute of Biological Products / Sinopharm
- Wuhan Institute of Virology / Sinopharm: Erfolge in letzter Testphase
- Weiterer Kandidat aus China: CanSino Biologics / Beijing Institute of Biotechnology
- Spezialisiert auf Impfstoffe: Das US-Pharmaunternehmen Nobvavax
- Sinovac Biotech: Große Studie in Brasilien vorerst gestoppt
- Janssen (Johnson & Johnson): Weltweit Tests der Phase III
- WHO will Ende von Studien abwarten
Mit dem britisch-schwedischen Pharmakonzern Astrazeneca hat ein weiteres Unternehmen positive Daten zu einem Corona-Impfstoff vorgelegt. Das Vakzin habe eine Wirksamkeit von im Mittel 70 Prozent gegen Covid-19, teilte das Unternehmen auf Basis von Zwischenergebnissen aus der wichtigen Testphase III am 23. November mit. Berücksichtigt wurden Daten zweier klinischer Studien mit verschiedener Dosierung. Die Wirksamkeit der Vakzine von Pfizer/Biontech und Moderna liegt für Doppelimpfungen nach vorläufigen Daten bei rund 95 Prozent.
Astrazeneca: Wirksamkeit von 70 Prozent
Der Astrazeneca-Impfstoff kann den Angaben zufolge bei Kühlschranktemperaturen von zwei bis acht Grad aufbewahrt werden. Berücksichtigt wurden für die Zwischenergebnisse zum einen Daten einer kombinierten Phase-II/III-Studie, bei der die Versuchspersonen der Impfgruppe zuerst eine halbe Dosis des Impfstoffs und einen Monat später eine weitere volle Dosis erhielten. Die Effektivität lag den Angaben zufolge hier bei 90 Prozent.
Zum anderen wurden Ergebnisse einer Phase-III-Studie berücksichtigt, bei der Probanden der Impfstoff-Gruppe zwei volle Dosen bekamen. Die bisher errechnete Effektivität lag dabei bei 62 Prozent. Zusammengenommen ergibt sich den Angaben zufolge eine Wirksamkeit von 70 Prozent. Die Zwischenauswertung basiert auf insgesamt 131 Infektionsfällen mit nachweislichem Covid-19.
Was für ein Impfstoff wird von Astrazeneca produziert?
Der Wirkstoff AZD1222 beruht auf der abgeschwächten Version eines Erkältungsvirus von Schimpansen. Es enthält genetisches Material eines Oberflächenproteins, mit dem der Erreger SARS-CoV-2 an menschliche Zellen andockt. Das Mittel wirkt zweifach: Es soll sowohl die Bildung von spezifischen Antikörpern als auch von T-Zellen fördern, beide sind für die Immunabwehr wichtig. Anders als die Impfstoffe der Mainzer Firma Biontech und des Pharmakonzerns Pfizer sowie der US-Firma Moderna gehört das britisch-schwedische Präparat nicht zu den mRNA-Impfstoffen.
Wie Vektorviren-Impfstoffe funktionieren
Als Basis für diese Impfstoffe dienen andere, harmlosere Viren wie etwa das Impfvirus Vaccinia oder aber ein abgeschwächter Impfstamm des Masernvirus. Diese Viren werden mit Bestandteilen des neuen Coronavirus SARS-CoV-2 bestückt. Die menschliche Immunabwehr reagiert im Idealfall auf dieses harmlose, als SARS-CoV-2 getarnte Virus, indem es Antikörper gegen das neue Coronavirus produziert.
Die Oxford-Forscher hatten erst kürzlich im Fachmagazin "The Lancet" berichtet, dass ihr Impfstoff in klinischen Tests der Phase II auch bei Älteren gut wirkt. In der Phase-II-Studie habe es bei Teilnehmern sowohl unter als auch über 56 Jahren eine gute Immunantwort gegeben, schrieb das Team. Das Vakzin sei von Älteren sogar besser vertragen worden als von Jüngeren. Den Angaben zufolge waren rund 240 der 560 gesunden Studienteilnehmer über 70 Jahre alt. Ältere Menschen haben ein erhöhtes Risiko für einen schweren Covid-19-Verlauf.
Oxford Universität mit Astrazeneca: Zulassung gestartet
Auch für den Impfstoff von Astrazeneca wird bereits die Zulassung in der EU geprüft. Der Forschungsprozess erlebte allerdings schon einige Höhen und Tiefen:
Anfang Oktober hatte die Europäische Arzneimittel-Agentur EMA noch eine spektakulär klingende Neuigkeit vermeldet: Die EMA hat mit einer Überprüfung des sogenannten Oxford-Impfstoffs gegen Covid-19 begonnen, an dessen Entwicklung der britisch-schwedische Pharmakonzern Astrazeneca beteiligt ist.
Ende Oktober allerdings schien der rasante Fortschritt zwischenzeitlich gefährdet: In Brasilien starb ein 28 Jahre alter Mann aus Rio während der Studie zu dem Vektorviren-Impfstoff AZD1222. Laut Astrazeneca und der brasilianischen Überwachungsbehörde für Gesundheit, Anvisa, gab es dennoch keinerlei Bedenken hinsichtlich der Fortsetzung der laufenden Studie.
Für den Wirkstoffkandidaten wird wie für den Biontech-Wirkstoff schon jetzt die Zulassung in der EU in einem sogenannten Rolling-Review-Verfahren geprüft. Astrazeneca plante bislang, bis Ende des Jahres mit der Produktion eines Impfstoffs zu beginnen. Der Abgabepreis pro Dosis soll laut Konzern-Chef Pascal Soriot 2,50 Euro betragen.
Die erste Testphase mit dem Wirkstoff war Ende April in Großbritannien gestartet. Seit Ende Juni wird er in Phase drei in Großbritannien, Brasilien, Südafrika und den USA geprüft. Bereits im Juli waren von der britischen Universität Oxford mutmachende Neuigkeiten vermeldet worden: Ihr Impfstoffkandidat habe bei der Erprobung an 1.077 gesunden Freiwilligen vielversprechende Ergebnisse geliefert. Viele Länder, auch Deutschland, haben mit Astrazeneca Verträge über insgesamt Milliarden Dosen abgeschlossen.
Oxford-Impfstoff: Wie sind die Ergebnisse zu bewerten?
Gerd Fätkenheuer von der Uniklinik Köln erklärte zu den Ergebnissen, dass die "sehr vorläufigen Daten" schwer zu interpretieren seien, etwa das Ergebnis, dass mit einer geringeren Impfdosis eine größere Erfolgsrate zu erzielen war als mit einer höheren. "Das ist zunächst nicht einleuchtend, und es müssen weitere Daten abgewartet werden, bis man das besser einschätzen kann." Bestimmte Werte sprächen dafür, dass der Astrazeneca-Impfstoff etwas weniger effektiv sein könnte als die beiden mRNA-Impfstoffe, zu denen bereits Daten vorgestellt wurden. "Insgesamt ist es jedoch sehr erfreulich, dass jetzt bereits ein dritter Impfstoff kurz vor der Einführung steht."
Auch die EMA warnte zuletzt trotz des bereits gestarteten Zulassungsverfahrens vor voreiligen Schlüssen: Dies bedeute noch nicht, dass der Impfstoff schon als wirksam und sicher eingeschätzt werden könne. Das müsse sich in der angesichts der Dringlichkeit in einem beschleunigten Verfahren vorgenommenen Überprüfung erst noch zeigen.
Bei dem jetzigen Verfahren wäre es denkbar, dass der Impfstoff schon wenige Tage nach dem Ende der Tests freigegeben wird – jedoch nur, wenn die Behörde von seiner Wirksamkeit und Unbedenklichkeit überzeugt ist. Wie lange die Überprüfung und Beurteilung dauern wird, kann die EMA nicht sagen. Tests mit Tausenden von Versuchspersonen seien im Gange, die Ergebnisse würden in den nächsten "Wochen und Monaten" erwartet.
Virologe Streeck hat Bedenken gegen Astrazeneca-Impfstoff
Der Bonner Virologe Prof. Hendrik Streeck zeigte sich zuletzt im Oktober skeptisch hinsichtlich des Astrazeneca-Wirkstoffs: Er betrachte die Daten der Impfstoffstudien ohnehin sehr vorsichtig, sagt er im Interview mit t-online. "Ein Astrazeneca-Impfstoff zum Beispiel wird wahrscheinlich bewirken, dass sich jemand infizieren kann und keinen schweren Covid-19-Verlauf hat." Das sei für die Corona-Pandemie suboptimal.
Denn, so Streeck: "Das Virus kann trotzdem weitergegeben werden – auch an die Menschen, die keine gute Immunantwort gegen SARS-CoV-2 aufbauen und somit nicht gut geschützt sind", so Streeck.
Zulassungsprozess in USA und EU: Biontech und Pfizer
Der Corona-Impfstoffkandidat des Mainzer Unternehmens Biontech und des US-Konzerns Pfizer verhindert den Herstellern zufolge 95 Prozent der Covid-19-Erkrankungen. Nach Abschluss der Analysen ihrer letzten klinischen Großstudie könne eine Wirksamkeit von 95 Prozent bestätigt werden, teilten die beiden Firmen am 18. November mit. Bei dem Mittel gebe es keine Sicherheitsbedenken.
Zwei Tage später dann die nächste Erfolgsmeldung: Biontech und Pfizer haben bei der US-Arzneimittelbehörde FDA eine Notfallzulassung für ihren Corona-Impfstoff beantragt. Das teilten die Unternehmen am 20. November in einer gemeinsamen Mitteilung mit.
Lieferung des Impfstoffs könnte zum Jahresende beginnen
Das ist ein großer Schritt auf dem Weg zu einem Corona-Impfstoff. Die Lieferung des Impfstoffs namens BNT162b2 könnte bereits Ende dieses Jahres beginnen, sollte es eine Genehmigung geben, hatte Biontech bereits mitgeteilt. Die Unternehmen sind die ersten westlichen Hersteller, die vielversprechende Studienergebnisse veröffentlicht und eine Notfallzulassung bei der FDA beantragt haben.
Die FDA muss den Antrag nun prüfen. Wie lange das dauern könnte, war zunächst unklar. US-Experten zeigten sich aber zuversichtlich, dass es noch vor Jahresende ein Ergebnis der Prüfung geben könnte. Für Corona-Impfstoffe gilt wegen der besonderen Dringlichkeit ein beschleunigter Zulassungsprozess.
Bei der europäischen Arzneimittelbehörde EMA und in weiteren Ländern reichen Biontech und Pfizer bereits permanent Daten ein. Mit diesem rollierenden Verfahren können Hersteller schon vor dem kompletten Zulassungsantrag einzelne Teile zu Qualität, Unbedenklichkeit und Wirksamkeit eines Präparats weitergeben. Einen kompletten Zulassungsantrag wie bei der FDA haben sie bei der EMA jedoch noch nicht gestellt. Bereits in der zweiten Dezemberhälfte könnte ein erster Impfstoff in Europa jedoch zugelassen werden, sagte EU-Kommissionschefin Ursula von der Leyen unter Bezug auf Informationen der EMA.
Impfdosen sollen nach Zulassung fair verteilt werden
Nach einer Zulassung sollen die vorhandenen Dosen nach Unternehmensangaben "fair" verteilt werden. Es werde nicht "ein Land alles erhalten". Deutschland und die EU haben bereits einen Rahmenvertrag über den Kauf von 300 Millionen Dosen des Impfstoffs von Biontech und Pfizer abgeschlossen.
Die FDA könnte demnach schon im Dezember grünes Licht für die Vermarktung geben, wie ein Vertreter des von der US-Regierung eingesetzten Krisenstabs mitteilte. Medizinisches Personal und Angehörige von Risikogruppen könnten dann bereits in der ersten Dezemberhälfte Zugang zu Impfungen bekommen. Für die Allgemeinheit in den USA soll der Impfstoff nach Angaben der US-Behörden ab April zur Verfügung stehen.
"Die Studie ist ein wichtiger Meilenstein in der historischen achtmonatigen Suche nach einem Impfstoff, der diese verheerende Pandemie beenden kann", erklärte Pfizer-Chef Albert Bourla.
Die Phase-3-Studie zu BNT162b2 hatte am 27. Juli in mehreren Ländern begonnen. Daran nehmen mehr als 43.500 freiwillige Probanden teil. Etwa die Hälfte von ihnen erhält ein wirkungsloses Placebo. Wie gut die Impfung funktioniert, lässt sich abschätzen, indem die Zahl der Covid-19-Erkrankungen unter den Geimpften mit der Zahl der Erkrankungen in der Placebogruppe verglichen wird.
Erste Informationen zu möglichen Nebenwirkungen
Teilergebnisse der Studie hatten zuvor eine Wirksamkeit von mehr als 90 Prozent bescheinigt. Nach den jüngsten Angaben vom 18. November erkrankten 162 Studienteilnehmer, denen ein Placebo verabreicht worden war, an Covid-19. In der Gruppe der mit dem Impfstoff behandelten Probanden erkrankten hingegen nur acht Teilnehmer.
Die Wirksamkeit ist laut der Studie unabhängig von Alter, Ethnie oder Geschlecht gleichbleibend. Bei älteren Patienten seien zudem weniger und schwächere Nebenwirkungen beobachtet worden.
Sollte sich die Wirksamkeit bestätigen, würde das Mittel zu den wirksamsten Impfstoffen überhaupt zählen – vergleichbar mit dem Impfstoff gegen Masern. Als einzig signifikante Nebenwirkungen seien bei einigen Studienteilnehmern Kopfschmerzen und Müdigkeit festgestellt worden, erklärten die Hersteller.
Langzeitwirkung wird weiter erforscht
Im Rahmen von Langzeitstudien wird nach Unternehmensangaben nun an 150 Orten weltweit die Langzeitwirkung des Impfstoffes weiter erforscht, unter anderem in den USA, Deutschland, der Türkei und Südafrika. So sollen auch langfristige Nebenwirkungen ausgeschlossen werden.
Der Transport des Pfizer-Impfstoffes hatte zunächst Fragen aufgeworfen, weil die Impfdosen bei Minus 70 Grad Celsius gelagert werden müssen. Die Unternehmen teilten mit, dass das Medikament in speziellen Containern mit Trockeneis gekühlt versandt werden solle, in denen es bis zu 15 Tage bei Temperaturen um -70 Grad Celsius gelagert werden könne.
Die USA, die EU und weitere Länder haben bereits Hunderte Millionen Dosen des Pfizer-Biontech-Impfstoffs vorbestellt. Das Unternehmen rechnet damit, in diesem Jahr noch 50 Millionen Dosen produzieren zu können.
- Corona-Impfstrategie: Wer soll zuerst gegen Covid-19 geimpft werden?
So funktioniert genbasierte mRNA-Technologie
Biontech setzt auf einen sogenannten mRNA-Impfstoff. Die mRNA (Englisch: messenger RNA) ist ein natürlicher Botenstoff, der die menschlichen Zellen dazu anregt, die eigenen Abwehrmechanismen gegen einen bestimmten Erreger zu aktivieren.
Dazu wird die mRNA mit genetischen Informationen des Erregers, hier konkret mit Informationen über das Spike-Protein des Coronavirus, bestückt und in die menschlichen Zellen eingeschleust. Im Idealfall erkennt der menschliche Körper dieses Protein als fremde RNA und wird zur Bildung von Antikörpern und T-Zellen gegen das Virus angeregt. Die SARS-CoV-2-Erreger werden dann abgefangen, bevor sie in die Zellen eindringen und sich vermehren können. Der körpereigene Abwehrmechanismus baut sich also auf wie bei einer natürlichen Infektion mit dem Virus.
Solche Impfungen mit Erbgut haben mehrere Vorteile gegenüber anderen Methoden: Zum einen besteht bei ihnen nicht das Risiko, dass sie selbst eine gefährliche Infektion auslösen, wie es etwa einer Impfung gegen Polio der Fall sein kann. Ein weiterer Vorteil dieser Technologie: Impfstoffe lassen sich so deutlich schneller produzieren als mit der Methode, für die erst Viren gezüchtet und gereinigt werden müssen.
US-Unternehmen Moderna: Was 94,5-prozentige Wirksamkeit bedeutet
Mit dem US-Pharmakonzern Moderna hat ein weiterer für Europa relevanter Hersteller vielversprechende Daten für seinen Corona-Impfstoff vorgelegt. Der Impfstoff mRNA-1273 habe eine Wirksamkeit von 94,5 Prozent, hieß es in einer Mitteilung von Moderna am 16. November. Zudem wurde bekannt, dass die Europäische Arzneimittel-Agentur (EMA) ein sogenanntes Rolling-Review-Verfahren zu dem Moderna-Impfstoff beginnt, das eine vergleichsweise rasche Zulassung anstrebt.
Die EU-Kommission verhandelt derzeit nach eigenen Angaben mit dem US-Konzern über die Lieferung von bis zu 160 Millionen Impfdosen. Ein Vertrag ist aber noch nicht geschlossen. Vor einer Woche hatte bereits der Mainzer Hersteller Biontech zusammen mit dem US-Konzern Pfizer bekannt gegeben, dass ihr Impfstoff einen mehr als 90-prozentigen Schutz vor Covid-19 bieten soll.
Die Phase-III-Studie mit dem Namen "COVE" von Moderna umfasst insgesamt 30.000 Probanden. Die Hälfte davon hat den Impfstoff erhalten, die andere Hälfte fungiert als Kontrollgruppe und bekommt ein Placebo-Mittel. Insgesamt erkrankten bislang 95 Studienteilnehmer an der Krankheit Covid-19. Davon entfielen nur fünf Fälle auf die tatsächlich geimpften Probanden, 90 Fälle wurden in der Kontrollgruppe diagnostiziert. Daraus errechnet sich eine Wirksamkeit von 94,5 Prozent.
Daten, zu welchem Grad mRNA-1273 eine Ansteckung verhindert, gibt es bislang nicht. Für den vollen Impfschutz sind zwei Dosen in zeitlichem Abstand notwendig.
Moderna plant Zulassungen – viele Fragen noch offen
Moderna will in den kommenden Wochen eine Notfallzulassung bei der US-Arzneimittelagentur FDA beantragen. Auch Anträge bei Zulassungsbehörden anderer Länder seien geplant.
Bis Ende des Jahres will der Konzern nach eigenen Angaben bereit sein, im Falle einer Zulassung rund 20 Millionen Impfdosen in die USA zu liefern. Im kommenden Jahr sollen bis zu eine Milliarde Dosen hergestellt werden.
Zwar haben schon Länder wie Russland, China und kürzlich erst Bahrain Impfstoffe mit Einschränkungen freigegeben und impfen damit bereits Teile der Bevölkerung. Aber wie gut diese Impfungen tatsächlich schützen und welche Nebenwirkungen sie haben können, ist derzeit weitgehend offen.
Moderna-Wirkstoff stabiler als der von Biontech
Der Corona-Impfstoff von Biontech erfordert besondere Bedingungen, bevor er eingesetzt wird. Er muss in konsequenter Kühlkette bei -70 Grad aufbewahrt werden.
Modernas Impfstoff hingegen ist laut Experten aufgrund einer synthetischen Verstärkung der RNA offenbar stabiler und deshalb weniger anspruchsvoll.
"Obwohl man einen guten handelsüblichen Tiefkühlschrank für die maximale Haltbarkeit benötigt, ist ein normaler Kühlschrank für 30 Tage ausreichend", sagt der Pharmakoepidemiologe Stephen Evans von der London School of Hygiene and Tropical Medicine der Nachrichtenagentur Reuters. Der Moderna-Impfstoff sei sogar für zwölf Stunden bei Raumtemperatur stabil.
Experte Fauci: "Besser wird es nicht"
Der renommierte US-Immunologe und Corona-Experte Anthony Fauci hat begeistert auf die Moderna-Daten reagiert. "Das sind offensichtlich sehr aufregende Ergebnisse", sagte Fauci nach Angaben des TV-Senders CNN. "Besser wird es nicht – 94,5 Prozent sind wirklich hervorragend", so Fauci.
Russlands "Sputnik V": angeblich 92-prozentige Wirksamkeit
Nur zwei Tage nach dem Mainzer Pharmaunternehmen Biontech und seinem US-Partner Pfizer hat am 11. November der russische Impfstoffentwickler verkündet, dass sein Vakzin zu mehr als 90 Prozent sicher sei. Die Wirksamkeit von "Sputnik V" liege bei 92 Prozent, teilten das Gamaleja-Forschungsinstitut und der russische Staatsfonds RDIF, der den Impfstoff finanziert, in einer gemeinsamen Erklärung mit.
Der russische Impfstoff befindet sich derzeit in der dritten und letzten Phase der klinischen Studien, in der er außer auf seine Verträglichkeit auch auf seine Wirksamkeit untersucht wird. Laut der Erklärung beziehen sich die Berechnungen nun auf ein Zwischenergebnis bei 16.000 Probanden, die zwei Dosen bekommen haben. Nur 20 Probanden, darunter auch aus der Gruppe der Placebo-Empfänger, hätten nach Erhalt der zweiten Dosis Covid-19 entwickelt.
Dies entspreche einer "Wirksamkeitsrate von 92 Prozent für den Impfstoff Sputnik V nach einer zweiten Dosis", hieß es in der Erklärung. Laut RDIF umfasst die klinische Studie insgesamt 40.000 Teilnehmer. Einige der Probanden entwickelten demnach grippeähnliche Symptome wie "Fieber, Schwäche, Müdigkeit und Kopfschmerzen".
Forschungsdaten sollen bald veröffentlicht werden
Laut der Erklärung wurde der Impfstoff im September separat Ärzten und gefährdetem Personal in Krankenhäusern verabreicht. Dabei habe er ebenfalls eine Wirksamkeit von "über 90 Prozent" gezeigt. Die Behörden der sibirischen Region Altai hatten hingegen berichtet, mindestens drei der 42 geimpften Krankenhausmitarbeiter hätten sich mit dem Virus angesteckt.
Russland hatte "Sputnik V" bereits im August zugelassen, ohne die letzte Testphase mit den Zehntausenden Probanden abzuwarten. Mitte Oktober wurde dann der zweite Impfstoff "EpiVacCorona" zugelassen. Bisher hielt sich das Land allerdings mit der wissenschaftlichen Dokumentation der Forschung zurück. Gamaleja und RDIF kündigten nun eine Veröffentlichung aller Daten "in den führenden medizinischen Fachzeitschriften, einschließlich der Begutachtung durch andere Wissenschaftler" an.
Experte: "Das ist kein Wettbewerb"
Experten bezeichneten die russischen Daten als ermutigend. Sie wiesen aber darauf hin, dass sie nur auf einer kleinen Anzahl von Studienteilnehmern beruhten. "Es gab sicher politischen Druck, nach den Pressemitteilungen von Pfizer und Biontech Anfang der Woche jetzt mit eigenen Zahlen nachzuziehen", sagte Bodo Plachter, stellvertretender Direktor des Instituts für Virologie an der Universität Mainz.
"Man braucht sicherlich eine längere Beobachtungsdauer, um valide Aussagen sowohl über die Wirkung als auch die Nebenwirkungen machen zu können." Das gilt nach Plachters Einschätzung aber auch für die Daten von Pfizer und Biontech.
Wissenschaftler äußerten auch Bedenken hinsichtlich der Geschwindigkeit, mit der Moskau an dem Impfstoff gearbeitet hat. "Das ist kein Wettbewerb. Wir müssen alle Versuche nach den höchstmöglichen Standards durchführen", sagte Eleanor Riley, Professorin für Immunologie und Infektionskrankheiten an der Universität von Edinburgh. "Alles andere riskiert einen öffentlichen Vertrauensverlust in alle Impfstoffe. Das wäre eine Katastrophe."
EU kritisch gegenüber Importplänen von Ungarn
Das nationale Gamaleja-Forschungszentrum für Epidemiologie und Mikrobiologie in Russland arbeitet an einem Vektorvirenimpfstoff namens "Sputnik V", dessen Zulassung für eine breite Anwendung in der Bevölkerung bereits nach der Erprobung an nur einigen Dutzend Probanden erfolgte.
Die dritte Testphase hat erst am 9. September in der russischen Hauptstadt Moskau begonnen, also rund einen Monat nach der Zulassung. Ersten Freiwilligen sei das Präparat gespritzt worden, sagte die Vize-Bürgermeisterin Anastassija Rakowa in Moskau der Agentur Interfax zufolge. Insgesamt sollen damit 40.000 Freiwillige landesweit geimpft und anschließend ein halbes Jahr lang medizinisch beobachtet werden. Nichtsdestotrotz will Russland laut Behördenangaben schon vor Ende der Studie erste Teile der Bevölkerung impfen – zuerst Lehrer und Ärzte.
Anfang November überraschte das EU-Mitglied Ungarn mit einem geplanten Alleingang, der statt auf einen in der EU zugelassenen Impfstoff auf einen Kandidaten aus Russland setzt: Wie der ungarische Außenminister Péter Szijjártó auf Facebook mitteilte, wolle sein Land im Dezember damit starten, erst einmal kleine Mengen des russischen Impfstoffes "Sputnik V" gegen Covid-19 zu importieren. Er soll laut dem Minister vor der Zulassung finalen Tests unterzogen werden. Ende Januar könnten die Importe dann aufgestockt werden.
Zuvor hatte auch Ungarns Premier Viktor Orbán bekannt gegeben, dass sein Land mit Peking und Moskau Gespräche über mögliche Impfstofflieferungen führe. Allerdings wird der russische Sputnik-Wirkstoff international und in der EU kritisch betrachtet, die Zulassung in Russland am 11. August sorgte weltweit für Aufruhr. Die EU steht diesem Vorstoß Ungarns allerdings höchst kritisch gegenüber.
Wie das russische Portal RBC berichtet, habe die EU-Kommission das Mitgliedsland vor dem Einsatz eines russischen Corona-Impfstoffs gewarnt. Der Grund: In EU-Ländern ist nur der Einsatz von Wirkstoffen erlaubt, die auch in der EU geprüft und zugelassen wurden. Die EU werde nur Präparate akzeptieren, die auf ihrem Gebiet hergestellt werden, hieß es vom Sprecher der Kommission, Eric Mamer. Laut Mamer gibt es bisher keinerlei Gespräche in dieser Sache mit China oder Russland.
Diese Corona-Impfstoffe sind noch in der letzten Testphase
Die Impfstoffkandidaten von Biontech und Pfizer, Moderna und aus Russland sind aber nur einige von zahlreichen weiteren potenziellen Wirkstoffen. Auch jetzt steigt die Zahl weiterer Impfstoffprojekte zu SARS-CoV-2 stetig weiter. Mindestens 214 gibt es derzeit laut dem Verband der forschenden Pharma-Unternehmen (vfa).
Dutzende Firmen und Institute testen aktuell ihre potenziellen Mittel in klinischen Studien an Freiwilligen – und das in nie dagewesener Geschwindigkeit: Weitere neun Wirkstoffe haben es bereits in die entscheidende letzte Phase der Erprobung an Freiwilligen geschafft (Stand: 12. November 2020). Wir stellen sie vor und erklären die verschiedenen Phasen der Impfstoffentwicklung.
- Infektionszahlen steigen: Wann wird bei Ihnen ein Corona-Test durchgeführt?
Mehrere Test-Etappen bis zum Zulassungsverfahren
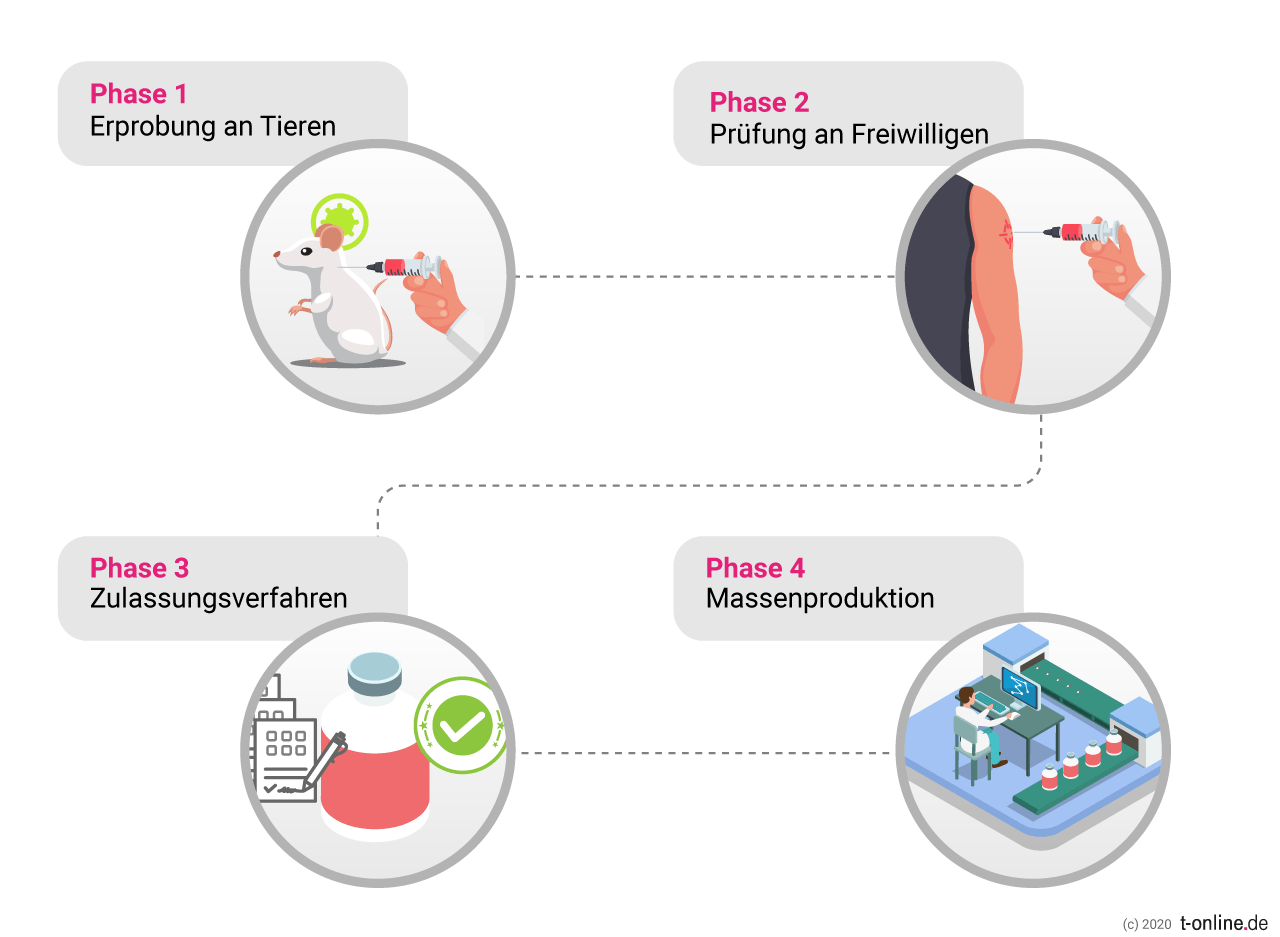
Der Vorfall bei Astrazeneca verdeutlicht, wie wichtig trotz aller Dringlichkeit die Erprobung der Wirkstoffe in ausführlichen Studien ist und dass es bei allen Fortschritten auch immer wieder zu Rückschlägen kommen kann. Bis zu seiner Zulassung muss ein Wirkstoff darum etliche Etappen erfolgreich durchlaufen haben:
Nachdem die Wirksamkeit und Verträglichkeit zuerst an Tieren erprobt, dann in der ersten klinischen Phase an einer kleinen Probandengruppe getestet und in der zweiten Phase an einer größeren Gruppe von 50 bis 500 Freiwilligen auf Verträglichkeit, Dosierung und die Art der Immunantwort untersucht wurde, folgt der dritte Testschritt:
Hier wird der potenzielle Impfstoff an einer Gruppe von mehreren Tausend Probanden auf die Zuverlässigkeit des Schutzes und mögliche seltene Nebenwirkungen geprüft.
Pharmakonzerne versprechen Sicherheit bei Entwicklung
Bewährt sich der Impfstoffkandidat, kann ein Zulassungsverfahren gestartet werden. Und das ist in einigen Ländern der Welt inzwischen quasi auf der Überholspur möglich.
Dennoch hatten Anfang September die neun Pharmakonzerne Astrazeneca, GlaxoSmithKline, Johnson & Johnson, Merck & Co., Moderna, Novavax, Sanofi, Biontech und ihr US-Partner Pfizer in einer Erklärung zugesichert, dass die Sicherheit und Wirksamkeit bei der Entwicklung eines Corona-Impfstoffes an oberster Stelle stehe.
Unterdessen testen weitere Impfstoffprojekte derzeit weltweit ihre Wirkstoffkandidaten in Studien der Phase drei:
Einer von zwei Kandidaten: Beijing Institute of Biological Products / Sinopharm
Das Beijing Institute of Biological Products forscht mit Sinopharm an einem Totimpfstoff, der mit inaktivierten Viren arbeitet. Eine Studie der Phase drei läuft derzeit in einer eigenen Anlage.
Die staatseigene China National Pharmaceutical Group (Sinopharm) testet zwei Covid-19-Impfstoffkandidaten an Menschen und verkündete Anfang Juli, den Bau einer neuen Anlage für Coronavirus-Impfstoffe in Wuhan abgeschlossen zu haben. Dieser soll die Anlage in Peking ergänzen, deren Bau im April vollendet wurde.
So wirken Totimpfstoffe
Die Variante der Impfung beruht auf inaktivierten Erregern und kann auf zwei Arten funktionieren: Entweder enthalten sie bestimmte Virusproteine oder aber das gesamte Material von inaktivierten SARS-CoV-2-Viren. Diese werden vom Körper als fremd erkannt und regen das körpereigene Abwehrsystem an, damit Antikörper und für die Abwehr wichtige T-Zellen gebildet werden. Auch die Impfung gegen Grippe, Masern oder Hepatitis B ist so konzipiert.
Wuhan Institute of Virology / Sinopharm: Erfolge in letzter Testphase
Ebenfalls weit fortgeschritten in der klinischen Erprobung an Menschen ist ein zweiter potenzieller Wirkstoff gegen Covid-19 von Sinopharm, der gemeinsam mit dem Wuhan Institute of Virology entwickelt wird. Auch dieser Impfstoff ist inaktiviert, setzt also auf abgetötete Krankheitserreger.
Der staatliche chinesische Biotechkonzern Sinopharm hat Mitte Juli in den Vereinigten Arabischen Emiraten mit 15.000 Freiwilligen mit der Phase-drei-Studie begonnen, auch in China und Bahrain läuft eine Erprobung in der letzten der klinischen Phasen.
Weiterer Kandidat aus China: CanSino Biologics / Beijing Institute of Biotechnology
In China entwickelt wird auch ein Wirkstoffkandidat namens Ad5-nCoV. Der Vektorvirus-Impfstoff arbeitet mit einem Adenovirus Typ 5 und wird in Phase-drei-Studien bereits in Pakistan und Russland erprobt, eine weitere Studie ist in Saudi Arabien geplant. Eine in Kanada geplante Erprobung wurde abgesagt.
Spezialisiert auf Impfstoffe: Das US-Pharmaunternehmen Nobvavax
Das US-amerikanische Pharmaunternehmen Nobvavax ist auf die Entwicklung von Impfstoffen spezialisiert und stieg Anfang des Jahres auch in die Corona-Wirkstoffsuche ein. Der Impfstoffkandidat soll in Baltimore im großen Maßstab hergestellt werden. Von der US-amerikanischen Regierung erhielt Nobvavax dafür im Juli 2020 1,6 Milliarden US-Dollar. Bis Anfang 2021 sollen 100 Millionen Impfdosen produziert werden.
Der Totimpfstoff mit der Bezeichnung NVX-CoV2373 arbeitet mit einem gentechnisch hergestellten Virusantigen (Nanopartikel-Technologie). Eine Erprobung der letzten klinischen Phase hat Ende September in Großbritannien begonnen, seit August laufen zudem Tests der Phase zwei in Australien, USA und Südafrika
Sinovac Biotech: Große Studie in Brasilien vorerst gestoppt
Das chinesische Unternehmen Sinovac Biotech forscht an einem potenziellen Wirkstoff gegen Covid-19 namens CoronaVac. Der Wirkstoff arbeitet mit dem inaktivierten Virus. Eine Studie der Phase drei wurde in Bangladesch ab August genehmigt. An der Erprobung in dem dicht besiedelten südasiatischen Land sollen 4.200 Freiwillige teilnehmen.
In Brasilien läuft bereits seit dem 21. Juli in Partnerschaft mit Instituto Butantan eine Studie der finalen Phase. Sie wurde jedoch mittlerweile von den brasilianischen Behörden gestoppt. Nach einem "ernsthaften negativen Vorfall" habe sie die Aussetzung der Tests mit dem Impfstoff CoronaVac angeordnet, teilte die Behörde Anvisa am 9. November mit. Demnach finden bereits seit dem 29. Oktober keine klinischen Studien mehr mit dem Impfstoffkandidaten statt.
Worum es sich bei dem "ernsthaften negativen" Vorfall genau handelte, teilte Anvisa nicht mit. Die genauen Umstände könnten aufgrund der Privatsphärerichtlinien nicht öffentlich gemacht werden, hieß es. Gemeint seien mit negativen Vorfällen jedoch Todesfälle nach der Verabreichung des Mittels, potenziell lebensgefährliche Nebenwirkungen, schwerwiegende Behinderungen, Krankenhausaufenthalte, Geburtendefizite und weitere "klinisch signifikante Vorkommnisse", erklärte Anvisa. Den Angaben zufolge war von dem genannten negativen Vorfall eine freiwillige Testperson betroffen.
Janssen (Johnson & Johnson): Weltweit Tests der Phase III
Das in den 50er-Jahren in Belgien gegründete Pharmaunternehmen Janssen hat einen Corona-Wirkstoffkandidaten namens Ad26.COV2-S ins Rennen geschickt. Der Vektorviren-Impfstoff wird seit dem 23. September in den USA, Brasilien, Chile, Kolumbien, Mexico, Peru, Südafrika, Ukraine und den Philippinen in einer Phase-drei-Studie erprobt.
Derweil läuft die Phase-zwei-Studie in den Niederlanden, Deutschland (UKE, Charité Berlin, Uniklinik Rostock) und Spanien noch weiter. Janssen ist Teil des globalen Gesundheitsunternehmens Johnson & Johnson.
WHO will Ende von Studien abwarten
Trotz aller Fortschritte und Zwischenerfolge bleibt die Weltgesundheitsorganisation (WHO) bislang aber noch zurückhaltend: Sie geht von einem Start der Covid-19-Impfungen erst zur Jahresmitte 2021 aus. Anfang des kommenden Jahres sollten die Daten aus den abschließenden Phase-III-Studien vorliegen, sagte eine WHO-Expertin kürzlich. Danach könnte über den Impfstart entschieden werden.
- Eigene Recherche
- Bundesinstitut für Arzneimittel und Medizinprodukte
- U.S. Food and Drug Administration (FDA): "Coronavirus (COVID-19) Update: FDA Takes Action to Help Facilitate Timely Development of Safe, Effective COVID-19 Vaccines"
- European Medicines Agency (EMA): "Guidance for medicine developers and companies on COVID-19"
- European Centre for Disease Prevention and Control: "Covid-19"
- The Lancet: "Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial"
- Bundesgesundheitsministerium: "Aktuelle Informationen zum Coronavirus"
- WHO: "Coronavirus disease (COVID-19) outbreak"
- Bundeszentrale für gesundheitliche Aufklärung: "Antworten auf häufig gestellte Fragen zum neuartigen Coronavirus"
- Europäische Union: "Coronavirus Global Response"
- Meldung auf RBC (Russisch)
- Deutsches Zentrum für Infektionsforschung
- Verband der forschenden Arzneimittelhersteller (vfa)
- The Lancet: "Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial"
- Nachrichtenagenturen AFP, dpa und Reuters
- Die Informationen ersetzen keine ärztliche Beratung und dürfen daher nicht zur Selbsttherapie verwendet werden.
Quellen anzeigen